家事に役立つナトリウム塩といえば、重曹(炭酸水素ナトリウムNaHCO3)が有名ですが、実は、炭酸ナトリウムはもっと役に立つのです。
普通にネットで買えるのは安心=食品添加物グレード、洗濯にもうがいにも
食品添加物ですから、下図のようにきれいに袋に入っています。

酸性の強すぎる食べものを中和することができます。(胃に入ると食塩になってしまうので、食塩の取り過ぎを避けるために、はっきりした目的なしに、食品の中和剤として使うことは避けるべきです) しかし、ここでおすすめの用途は、食品ではなく、
などが、ざっと挙げられます。食品添加物グレードだと、何に使うにしても安心です。(すでに書いた記事については、リンクを入れておきました)
食塩摂取量との関係
炭酸ナトリウムの分子式はNa2CO3。1モル質量は約106グラム(以下、約を略します)。ナトリウムの原子量は23グラムですから、炭酸ナトリウム1モル当たり(Na2で)ナトリウムが46グラム。食塩の分子式はNaCl。1モル質量は約58グラム。Na2のナトリウム46グラムは2(NaCl)食塩相当量として58×2=116グラムとなります。
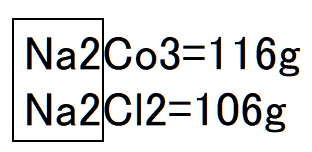
のように言えます。
ざっと言えば、
炭酸ナトリウムは、ほぼ同グラム(106と116)の食塩相当量となります。
病気の関係で、食塩の摂取を制限されている方は、このことを念頭に置いておかれると、よろしいかと、思います。たとえば、うがいに使う場合、100ccの水に炭酸ナトリウムを0.1グラム溶かして、口内に5cc残り(ティースプーン一杯が4ccです)、飲み込んでしまったとして、食塩摂取量は0.1÷(100÷5)=0.005グラムとなります。これを1日に10回やると、0.05グラムの食塩摂取となります。
炭酸ナトリウム濃度とpH(アルカリ度)
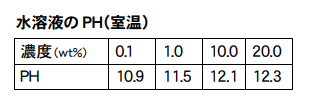
pHを考えますと、100ccの水に炭酸ナトリウムを0.1グラム溶かすと、0.1%となります。下図の資料ではpH約11。
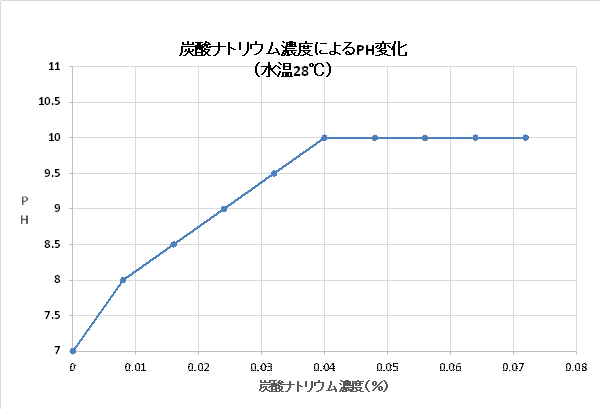
以下は、pH試験紙を使った私の実測値です。水5Lに炭酸ナトリウムを0.4gづつ加えていって、pHを測定しました。上表と同じ重量%としてあります。実際に洗濯に使う程度の薄い濃度で測っています。(0.5刻みの、色相見なので、参考値として見てください) 0.04%(水30Lに炭酸ナトリウム12g)で、pH10になり、それ以降は、炭酸ナトリウムの濃度を上げても、pHの読み数値としては、なかなか上がりません。0.1とかpHは上がっているのでしょうが、0.5刻みの、色相見では分かりません。
東京都クリーニング生活衛生同業組合(洗剤を知る~中性と弱アルカリ性~)によりますと、クリーニングの基準として、11までが弱アルカリ性とされています。
弱アルカリ性はpH11まで(家庭ではこの範囲で使用してください)
ついでで、組合さんには失礼なのですが、次の図も、大変、役に立ちそうなので、引用させていただきます。
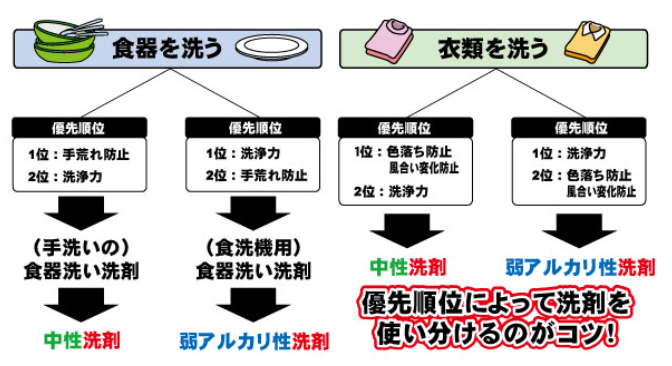
体を洗う、あるいは体にかかることでは、炭酸ナトリウムの濃度は、水100ccに0.1グラム(0.1%)以下を基準として考えると良いでしょう。
実際には、水1000cc(1リットル)に炭酸ナトリウム0.3グラム(0.03%で、pH9.5くらい)が、台所仕事、鼻うがい、喉うがいなどにふさわしい濃度だと、やってみた経験として、思います。0.3グラムというと、ほんの少しです。最小表示が1グラムの秤だと、0グラムのままです。
ちなみに、炭酸ナトリウム0.1グラムの写真を撮ってみました。

粉のまま使ってはいけない
重曹でしたら、かなり濃い濃度でもほぼ中性です。(1%-1リットルに10グラム-の濃度でpHは8.5)
しかし、炭酸ナトリウムの場合は、上記の表のように、1%ではpH11を超えてしまいます。何に使うにしても、家庭内では0.1%を超えないようにしたほうが良いでしょう。
粉を手にふりかけて洗うと、汚れがよく落ちますが、手が荒れてきます。
水中の金属(特にカルシウム分)と結合して白く濁る
炭酸ナトリウムを水に溶かして、その時は澄んでいても、しばらくすると、白く濁ってきます。水中の金属イオンと、炭酸ナトリウムの炭酸イオンが結合して炭酸金属(特に炭酸カルシウム)になるためです。普通の洗濯洗剤にも炭酸ナトリウムが入っているものがありますが、この白濁を防ぐために、「金属イオン封鎖剤」と言われるものが、使われたりします。
この白濁は、私が住む千葉でも起こります。関東は、上流部に酸性の強い水流があって、それを中和するために、近場で算出する石灰を入れて中和している、という話も聞いたことがあります。そのために、石灰分が少し多いようです。(そのため、普通に飲んでいてカルシウム分をよく摂取できる、とも言えます)
この金属イオン封鎖にクエン酸三ナトリウムが効果あるとも、言われています。(やってみましたが、実感なしでした) 少量の水溶液の場合は、溶かして、しばらく放置して、上澄みを使う、とかできます。
炭酸ナトリウムの具体的な使い方については、今後の記事にするとして、以上、ここでは、炭酸ナトリウムの概要について、書きました。
当研究所(分館)の記事
洗濯に洗剤は必要不可欠なのか? 炭酸ナトリウムさっぱり洗濯のおすすめ
も、参考になるかと思います。
ついでに、セスキ炭酸ナトリウムについて
炭酸ナトリウムのついでで、セスキについて、ウィキペディアなどの記事を、この際と思い、家事の観点からまとめてみました。
セスキ炭酸ナトリウムの化学式は、
Na2CO3・NaHCO3・2H2O
です。(左が)炭酸ナトリウムと(中央が)炭酸水素ナトリウム(重曹)が(右の水分子1つとついて)、複塩として共存し安定している状態で、自然界にはトロナと呼ばれる鉱石として土中に存在し、世界各国で採掘されているそうです。炭酸ナトリウムと重曹を半々に混ぜても、溶かしてしまえば同じものになります。
セスキ炭酸ナトリウムのpH
(pHの値がネット上に載っていることがありますが、濃度、温度によって変わってくるので、一概に、「何々はpHいくら」、とは言えません。温度は常温(20℃~25℃)としても、この濃度でいくら、ということで書かれていないものは、「濃度はどうなんだろう?」と思いながら、一つの目安程度に読んでください。)
セスキ炭酸ナトリウムのpHは、
9.8(1%、25℃)
9 (0.07%、28℃、私の実測値)
(9.8(1%、25℃)については、石けん百貨より) (実は、ウィキペディアには「9.6〜10(5%水溶液)」とあります。今手元にはセスキ炭酸ナトリウムがないので、炭酸ナトリウムと炭酸水素ナトリウムを半々で合計4.8グラムを500グラムの水に溶かして(0.1グラム以下は測れないので、まあ1%と見てください)測ってみました。pH1刻みの試験紙で10というところでした。9.8は妥当なところですね。ウィキペディアは、転記ミスみたいです。)
また、洗濯に使うかもしれない程度の濃度(0.07%、30Lに20g)にして0.5刻みのpH試験紙で測ってみました。pH9でした。この濃度では、炭酸ナトリウムとpHで1違いました。
炭酸ナトリウムのpHは、
11.3(1%)
(ウィキペディアより)(上記の讃岐化成株式会社の表とほぼ合います)
重曹のpHは、
8.5(1%、25℃)
(AGCのサイトより)。同じ濃度で11.3と8.5の平均が9.9ですから、嘘みたいに、セスキ炭酸ナトリウムのpHは、足して割った値になっています。
炭酸ナトリウムは、セスキよりも白濁しにくい
炭酸ナトリウムは、セスキ炭酸ナトリウムの10分の1の濃度(0.1%)で、pHが10.9(上記の讃岐化成株式会社の表による)です。
炭酸ナトリウムは、セスキ炭酸ナトリウムの10分の1以下の量で、セスキ炭酸ナトリウム以上のアルカリ度に達する
と言えます。
低コストで済むだけでなく、炭酸イオンが少なくなるので、白濁しにくくなります。これは、pH測定の際に、実感したことです。
まとめますと、1%濃度の水溶液でpHは
重曹(炭酸水素ナトリウム) 8.5
セスキ炭酸ナトリウム 9.8
炭酸ナトリウム 11.3
この際、ついでに水酸化ナトリウム(苛性ソーダ)も
水酸化ナトリウム 13.4
となります。
水酸化ナトリウムのpHについては、水酸化ナトリウム グラムからphを計算を利用させていただきました。

という具合です。
ついでに、過炭酸ナトリウムについて
いわゆる、酸素系漂白剤と言われているものです。化学式は、
2Na2CO3・3H2O2
過炭酸ナトリウムといっても、「過炭酸」のナトリウム塩ではなくて、過酸化水素と炭酸ナトリウムの安定混合物なのです。炭酸ナトリウムと過酸化水素が 2:3 のモル比で混合された付加化合物です。
過炭酸ナトリウムとは、過(酸化水素と)炭酸ナトリウム
過(酸化水素と)炭酸ナトリウムということですね。過炭酸ではありません。
過***酸というのは、たとえば、肥料としておなじみの過リン酸石灰ですと、リン酸石灰=Ca3(PO4)2に硫酸を加えて反応させて、過リン酸石灰=Ca(H2PO4)2を作ります。カルシウム1に対して、リン酸は3分の2から、2に増えています。リン酸が余分にくっついて、過リン酸ということですね。
過炭酸ナトリウムは空気中では比較的安定しています。(それでも、徐々に過酸化水素ガスが分離・放出されるので完全密封はやめておきましょう) 水中では、過酸化水素と炭酸ナトリウムに(さらに活性酸素と水に)分離してしまいます。荒っぽく言えば、炭酸ナトリウムとオキシフルを入れるようなものですね。2Na2CO3・3H2O2の分子量は314です。2Na2CO3の分子量は212です。ざっと考えて、過炭酸ナトリウムの投入量の3分の2の重量の炭酸ナトリウムを入れていることになる、ということですね。

コメント